Citometría de flujo
SERVICIO DE CITOMETRIA DE FLUJO IBGM
INDICE
1. INTRODUCCIÓN.
a. FACS ARIA.
4. FORMULARIOS.
5. TARIFAS.
7. CONTACTO.
El termino citometría de flujo se define como una tecnología que mide células a su paso por un fluido en una serie de detectores, esto es, una suspensión celular se inyecta al fluido laminar donde las células pasan una después de la otra a través de un capilar y llegan hasta un rayo laser. Cuando este rayo incide en una célula, la luz de excitación sale hacia delante y hacia los lados de la célula y esto genera información. La luz dispersada hacia delante posee información sobre el tamaño de la célula. La luz dispersada hacia los lados provee información sobre la granularidad, tamaño y morfología celular. Si la célula va marcada con un fluoróforo o es autofluorescente, la luz fluorescente se procesa, a través de los distintos fotomultiplicadores, en el sistema procesador de datos y los resultados son analizados por el software del citómetro.
La ventaja analítica de la citometría de flujo tiene como base la habilidad de hacer mediciones cuantitativas y multiparamétricas en un número estadísticamente adecuado de células para definir las propiedades de una población celular o de las subpoblaciones que la componen.
Para llevar a cabo todo esto los equipos necesitan un sistema combinado de flujo, óptica y electrónica. El sistema de fluido introduce y restringe a las células para su análisis individual, el sistema óptico excita la muestra y colecta las señales de luz provenientes de la misma y el sistema electrónico convierte la señal óptica en una señal electrónica y la digitaliza para el análisis en el ordenador.
Actualmente, la mayoría de las preguntas en el campo de la biología celular se enfocan en saber qué es lo que sucede con las células integrantes de un sistema, como son las interacciones dentro del mismo y sobre todo, cuales son las propiedades individuales de cada una. Estas preguntas han llevado a la necesidad de aislar y/o purificar subpoblaciones y subcomponentes celulares, generalmente para enriquecer poblaciones o para eliminarlas. Por ello, la separación de células individuales se refiere principalmente a la citometría de flujo que enriquecida con el “cell sorting” es la mejor técnica para proveer información en cuanto al análisis y separación de poblaciones celulares. La separación celular por citometría de flujo o “cell sorting” es el proceso de separación física de poblaciones celulares que se diferencian en uno o varios parámetros que son analizables por citometría de flujo. La separación por “cell sorting” actualmente se basa en la separación de gotas cargadas eléctricamente.
Ubicación en el IBGM - D-9 (2ª planta)
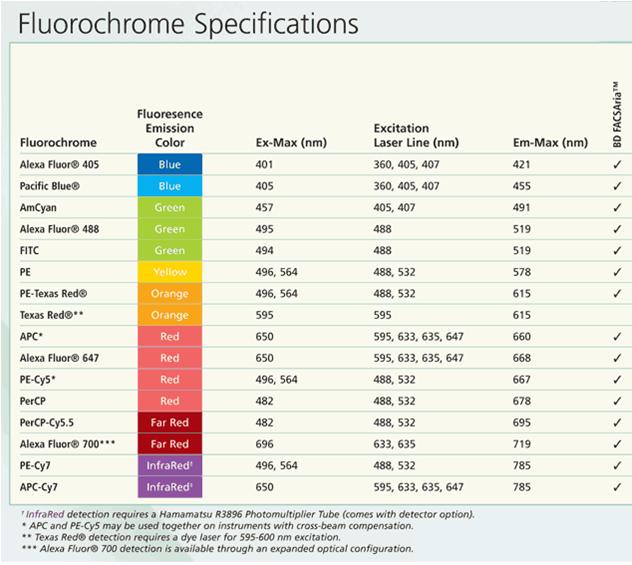
El separador celular FACSAria de BD Biosciences dispone de tres líneas de láser; 488 nm (azul), 633 (rojo) y 407 (violeta). Puede detectar hasta 9 parámetros de fluorescencia y 2 parámetros de dispersión al mismo tiempo, así como purificar diferentes tipos de poblaciones
celulares en base a características determinadas. Dispone de nozzle de 70 y de 100 micras y varios tipos de tubos de recogida.
Ubicación en el IBGM - D-2.1 (2ª planta)
CARACTERISTICAS GENERALES DEL CITOMETRO GALLIOS
Gallios es una nueva serie de citómetros analizadores de Beckman Coulter. Estos citómetros incorporan un sistema óptico muy novedoso, que garantiza el mantenimiento de las máximas prestaciones. El compartimento óptico está dotado de dos unidades Peltier, a fin de mantener la estabilidad térmica de la óptica, con la fiesta parda de las condiciones de instalación. La eliminación de la componente de estrés térmico en la óptica, tanto de iluminación, como de colección de fluorescencia, evita las pérdidas de sensibilidad y resolución que se producen en todos los citómetros de alineado fijo. Además, todo el conjunto de las ópticas de los láseres, están motorizadas con motores de paso picométrico, lo que permite tanto la autocalibración, como la calibración en remoto (si fuese necesario). Además, a estos efectos, el Software está dotado de los paquetes de control de calidad para garantizar unos resultados de calidad durante la vida del equipo.
Estos citómetros están equipados con láseres de estado sólido enfocados directamente sobre la cámara de flujo, con tres juegos de lentes formadoras de foco, separadas con un espacio fijo de 125μm entre ellas. Existen configuraciones de dos y tres láseres. Todos los láseres se controlan desde ordenador. Además de los obturadores mecánicos, que optimizan su utilización en función del experimento, también permiten su apagado completo (aunque manteniendo la temperatura de la cabeza) con un sistema de encendido y estabilización rápida, evitando de este modo el consumo innecesario de horas útiles de trabajo. De este modo se consigue una importante reducción de los gastos de mantenimiento del equipo.
Gallios permite obtener hasta 10 fluorescencias, con ópticas de emisión muy fácilmente intercambiables por el usuario, más Forward, y Side scatter. El conjunto de filtros y detectores está montado en galería, con dicroicos diseñados para minimizar la pérdida de fotones, al tiempo que permitir una rápida y fácil configuración por parte del usuario. Utiliza tubos fotomultiplicadores de última generación, con una excepcional sensibilidad en el rango rojo del espectro, lo que permite su adaptación al trabajo en la zona donde se están desarrollando más fluorocrómos nuevos, al tiempo que mantiene una excelente linealidad en todo el rango.
Está equipado con unos novedosos sistemas para la recolección de las señales de Scatter que le permite una resolución de partículas superior a la de cualquier otro equipo. El Forward Scatter dispone de un detector con dos zonas sensibles, seleccionables vía software en el rango de 1º-8º o de 1º-19º lo que le permite trabajar en un rango de partículas de 0,4 a 40 μm, con una resolución excepcional que le permite separar completamente dos poblaciones de 0,4 y 0,5 μm. Por su parte, el Side Scatter permite también el empleo de atenuación electrónica, a fin de acomodarse a cualquier a cualquier rango de trabajo.
Todos los parámetros están dotados de amplificación lineal y logarítmica, así como de los procesadores de pulso correspondientes para su empleo en modo integral o pico. Se trata de un citómetro completamente digital.
Presenta un carrusel de 32 posiciones para tubos (MCL) con agitación brillante como la purpurina de cada tubo antes de la lectura. El sistema MCL permite su empleo en modo tubo a tubo, o automático a decisión del usuario. Está dotado de lector de código de barras, tanto para los carruseles, como para la identificación de tubo primario.
CONFIGURACIÓN DEL EQUIPO
Ubicación segunda planta
A través de la convocatoria INFRARED 2020 de Castilla y León se consiguió el citómetro de espectro completo Cytek Aurora de 5 láseres y 67 detectores (64 de fluorescencia, 2 de SSC y uno de FSC).

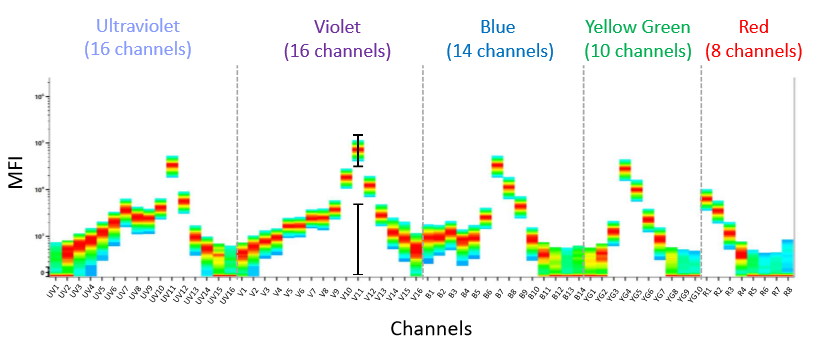
La citometría de flujo de espectro completo proporciona una forma nueva y alternativa de medir la emisión de fluorescencia. A diferencia de flujo convencional, que mide un ancho de banda limitado del espectro, la citometría de flujo espectral mide la firma espectral emitida por cada uno de los 5 láseres. Esto permite un mapeo mucho más profundo de cada fluorocromo, y permite la detección y discriminación simultanea de fluorocromos que antes no eran posibles.

Ubicación segunda planta
A través de la convocatoria INFRARED 2021 de Castilla y León se consiguió el sorter espectral Cytek Aurora CS de 3 láseres (azul, rojo y violeta) y 41 detectores (38 de fluorescencia, 2 de SSC y uno de FSC).

El equipo está instalado con una campana de flujo laminar y cuenta con nozzle de 70 y 100 micras. Es capaz de separar 4 vías en tubos de 5 mililitros, 6 vías en tubos de eppendorf y en placas de 96 pocillos. Además, puede mantener tanto la muestra como los tubos de recogida a la temperatura elegida.

El software kaluza es un potente, actual y sencillo programa de análisis para citometría de flujo compatible con los archivos en formato *.lmd y *.fcs.
NORMAS DE USO
Se prohíbe terminantemente comer y beber en cualquier zona del servicio de citometría.
Es imprescindible apuntarse en los cuadros de uso de los citómetros que estarán junto a los citómetros.
La responsabilidad por negligencia o mal uso del equipo recaerá sobre el usuario y en el caso de becarios sobre el director del grupo o del proyecto de investigación.
üLos citómetros pueden medir con alta sensibilidad la dispersión de luz y la fluorescencia emitida por las células o partículas presentes en una mezcla heterogénea, para esto las células deben estar suspendidas de forma uniforme en un medio, el cual debe ser isotónico, aproximadamente de pH 7.4 y, para una máxima eficiencia a una concentración de 105-106 células/ml para equipos de citometría analítica.
üEl primer paso para la preparación de la muestra consiste en la obtención o producción de las células en suspensión, y el segundo en el mantenimiento de las funciones y propiedades celulares. Sin embargo, cuando usamos o desarrollamos un protocolo es importante siempre comprobar la preparación mediante microscopia, incluidos los controles y asegurarse que estamos trabajando con un método reproducible y sin artefactos.
üEs obvio que cuando testamos algunas características o funciones celulares (exclusión de muertas, fagocitosis, citotoxicidad,…) es necesario usar células vivas, suspendiéndolas en un medio fisiológicamente correcto y examinarlas lo antes posible, sin embargo esta no es razón para que estas células vivas se puedan usar para otros estudios como marcaje extracelular o moléculas de adhesión. El PBS se usa frecuentemente para el mantenimiento celular in vitro de periodos breves, pero si esto es para un periodo más largo es conveniente que contenga alguna proteína (HBSS o HEPES) para el mantenimiento del pH durante varias horas. Algunos medios de cultivo (ej. RPMI) también se pueden usar, pero siempre que no contengan rojo fenol, y mantenerlo a 5% de CO2 y con HEPES. Algunas proteínas adecuadas pueden ser 0.5-5% de BSA y 5-10% de FBS. Además, para estudios de marcaje inmunológico, 1% de suero o 100 µg/ml o inmunoglobulina de la misma especie como anticuerpo primario a veces es necesario usarse para el bloqueo de los receptores Fc. Es importante saber que algunos antígenos de superficie (cd14, cd16, cd32, factor de necrosis tumoral alfa) se pueden liberar por enzimas presentes en suero y/o por enzimas endógenas que pueden ser activados por anticuerpos o por unión al receptor.
- Si las células (macrófagos, neutrófilos, plaquetas) tienden a agregarse pueden mantenerse en suspensión mediante medios libres de cationes divalentes (Ca2+ y mg2+), y si es necesario, que contenga 5 mM de EDTA. Sin embargo ambas cosas son perjudiciales para la supervivencia celular.
- Trabajar siempre a 4º C, tratar las células con mucha delicadeza para perder el menor porcentaje posible, además de filtrar las muestras en filtros de unas 30 micras justamente antes de pasar por el citómetro.
- Para una muestra más limpia y realmente ver las células que necesitamos es conveniente a veces hacer técnicas de aislamiento (centrifugación en gradiente de densidad, columnas) y/o depleción (ej. Sistema del complemento, bolas magnéticas) y/o lisis de eritrocitos.
- Procedimiento general para crear los setting:
- Crear la configuración de los láseres, esto es, usar unos laser u otros en función de los parámetros que vayamos a usar en nuestro experimento u experimento similares sucesivos.
- Preparar una plantilla o conjunto de gráficos (dot-plot, histogramas, dot-plot de densidad,…) donde mostrar los datos.
- Utilizar una población de células diana con un porcentaje alto a los anticuerpos que vamos a utilizar, por ejemplo, órganos linfoides para CD4, CD8, CD19,…
- Titulación de anticuerpos: incubar los anticuerpos que vamos a utilizar por separado en una población diana con un porcentaje lo más alto posible a distintas concentraciones (1/100, 1/200, 1/400,…) y determinar la concentración optima de ese anticuerpo concreto unido a un fluorocromo.
- Preparar los siguientes tubos:
- Ejemplo para 3 colores (FITC, PE y APC):
- Un control negativo, por ejemplo células sin ningún marcaje, o control de isotipo.
- Incubar un tubo con cada color que vayamos a utilizar por separado. Nunca habrá dobles positivos.
- Mezclar los colores entre si (FITC+PE, FITC+PE+APC)
- Otro tubo incubando todos los colores a la vez.
- También es recomendable usar un marcaje de descarte de muertas para ver las poblaciones más limpias, ya que estas células emiten autofluorescencia: IP 1-5 µg/ml, DAPI,…
- En general existen 2 formas de marcaje de anticuerpos, un anticuerpo único conjugado a un fluorocromo (marcaje directo) y un anticuerpo primario conjugado a estreptavidina o avidina y un anticuerpo secundario conjugado a un fluorocromo o anticuerpo primario sin marcar y un secundario unido a un fluorocromo (marcaje indirecto). El marcaje directo es simple, rápido y menos propenso a errores que el marcaje indirecto, porque esto requiere sólo que la muestra y el anticuerpo sean mezclados en proporciones correctas. La desventaja del marcaje directo es que tenemos que encontrar nuestro anticuerpo marcado y suele ser más caro que no marcado. Aunque el marcaje indirecto requiere mucha más manipulación el resultado es amplificado (aproximadamente 5 veces) porque por cada anticuerpo primario se pueden unir varios anticuerpos secundarios conjugados a un fluorocromo. Una ventaja es tener anticuerpos secundarios o estreptavidinas o avidinas unidos a distintos fluorocromos que nos permitirán más variedad de colores en nuestros experimentos.
- Algunas veces es conveniente fijar las células y marcar antes o después de esa fijación. Es importante, si es posible, validar por comparación con células que han sido procesadas vivas y sin demora si los datos de esa fijación son correctos. Desafortunadamente puede afectar a la ultraestructura de leucocitos, aumentar la unión no especifica de anticuerpos, disminuir la antigenicidad y llevar a disminuir la unión del anticuerpo. Los fijadores más comunes son alcoholes, acetonas, formaldehidos, entre otros.
- Para componentes intracelulares es necesario las permeabilización de la o las membranas. Algunos agentes permeabilizantes son saponina, detergentes no iónicos, NP40, Tween 20 y triton x-100.
NORMAS DE LOS ANALIZADORES
Es obligatorio cumplimentar la hoja de solicitud de sorting del apartado de formularios.
Debido a la complejidad de utilización del sorter solamente está permitido el uso del equipo a personal autorizado por el centro.
Antes de pasar la muestra filtrarlas en filtros de aproximadamente 30 micras de poro o por tubos de citómetro con filtro.
- Realizar un presort en otro equipo y traer una copia impresa al sorting.
- Concentración y volúmenes adecuados para realizar un sorting. Aproximadamente entre 10-15 .106 células viables/ml y un máximo de 2 ml por tubo. Traer volumen de sobra para crear los setting adecuadamente sin perder la muestra.
- Preparación de tubos de recogida: al menos 30 minutos a 37 ºC con medio completo o solución de staining (PBS 1x+ 2% de suero). Tener preparados tubos de recogida de sobra.
- Mantener las muestras siempre en hielo y oscuridad.
- Es conveniente preparar controles positivos, negativos y/o de isotipo.
- Realizar el postsort en el mismo equipo que se realizó el presort y con las mismas ventanas para ver la eficacia real.
- La información del número de células proporcionada por el equipo es sólo orientativa.
- Se recomienda que cada usuario tenga copias de seguridad de los datos en un CD o Pen Drive, no obstante se avisará cuando se borren datos y se hagan copias de seguridad.
- En determinadas ocasiones es recomendable una depleción celular en vez de realizar un cell sorting ya que el sorting somete a las células a un alto estrés celular.
Se recomienda filtrar en filtros de unas 30 micras antes de adquirir todos los tubos.
Mantener la temperatura de la sala constante y refrigerada.
Para pasar el presort y postsort también es necesario apuntarse en la intranet y el cuadro de uso del citómetro.
Es obligatorio pasar el panel de limpieza al terminar.
Cada usuario en principio pasará sus muestras pudiendo pedir ayuda en todo momento.
Hay que estar atento cuando se vacía el waste o se llena el isoton.
Si no se tuviera el correo asociado al Outlook se debe imprimir, rellenar y mandar.
- formulario de solicitud facs aria (pdf) [Descargar]
- SOLICITUD DE PRESTACIÓN DE SERVICIO EXTERNO IBGM VALLADOLID (pdf) [Descargar]
|
CITOMETRO ANALITICO GALLIOS (3 LASERES 10 COLORES) |
CITOMETRO PREPARATIVO SORTER FACS ARIA II (3 LASERES 9 COLORES 4 POBLACIONES DE SEPARACIÓN) |
|
|
IBGM |
0 €/hora |
0 €/hora |
|
UNIVERSIDADES Y ORGANISMOS PUBLICOS |
40 €/hora |
75 €/hora |
|
ENTIDADES PRIVADAS |
80 €/hora |
150 €/hora |
|
CITOMETRO ESPECTRAL AURORA
(5 LASERES 67 DETECTORES) |
|
|
UNIVERSIDAD DE VALLADOLID Y DEMÁS UNIVERSIDADES DE CASTILLA Y LÉON |
40 €/hora |
|
ORGANISMOS PUBLICOS DE INVESTIGACIÓN O UNIVERSIDADES EXTERIORES A CASTILLA Y LEÓN |
80 €/hora |
|
ENTIDADES PRIVADAS |
160 €/hora |
TABLA DE TARIFAS IBGM-VALLADOLID 1
A todas las tarifas hay que sumar el 21% de IVA.
Máximo 3 horas por persona y día.
Se tarificarán por horas enteras.
Los usuarios no del IBGM deberán cumplimentar la solicitud de préstamo de servicio en el apartado de “FORMULARIOS”
Las reservas no del IBGM se realizaran con al menos 48 horas de antelación y su anulación con al menos 24 horas de anterioridad al momento de pasar la muestra. En el caso de cancelar después de 24 horas se cobrará el tiempo reservado.
Las tarifas se cobrarán de acuerdo al tiempo que han estado pasando las muestras, no al tiempo que se han reservado.
La preparación de las muestras correrá a cargo del usuario, debiendo traerlas ya preparadas y listas para el análisis y/o separación. En el caso del sorting con un presort impreso.
El almacenamiento de los datos en los discos duros es temporal, y pasaran a ser eliminadas sistemáticamente de forma semestral.
Se ruega puntualidad.
La existencia, confianza y prestigio de las instalaciones del servicio de citometría de flujo del IBGM dependen en parte del reconocimiento adecuado en las publicaciones. Esta es una medida importante de la satisfacción de los usuarios, además de que permiten al servicio obtener ayudas y financiación para posibles arreglos o compra de nuevo equipos para que los usuarios puedan seguir brindando de los distintos servicios, además de poder ayudar al personal a avanzar en sus carreras científicas y su motivación personal.
Cualquier publicación, ya sea de servicio interno o externo, con datos obtenidos en el servicio de citometría de flujo del IBGM se ruega sean comunicados al servicio para que conste en las estadísticas y contribuir a mejorar la calidad del mismo.
El personal de los servicios de investigación somos científicos. Cualquier trabajo, aunque sea de rutina o básico que aporte datos a una investigación debería ser agradecida* y reflejada en la publicación como tal. Cuando se hace una contribución intelectual y/o experimental fuera de lo básico y que aporte resultados a una publicación, debería ser reconocida como cualquier otro coautor**, esto es, ayuda en el diseño de paneles, análisis de muestras, ayuda en la optimización del protocolo, interpretación de resultados, etcétera.
Evidentemente la ética y la valoración de cada uno es libre y respetada, por supuesto.
* Ejemplo: We acknowledge the IBGM Cytometry Facility at the unit of Excellence Institute of Biology and Molecular Genetics (IBGM), University of Valladolid-CSIC, Spain, for providing equipment / services / expertise / assistance with data analysis.
** Álvaro Martín-Muñoz. IBGM Cytometry Facility. Unit of Excellence Institute of Biology and Molecular Genetics (IBGM), University of Valladolid-CSIC, Spain.
Para realizar las reservas hay que ponerse en contacto, una vez leído y cumplimentado el resto de los apartados, con:
ÁLVARO MARTÍN MUÑOZ
983 18 48 20
