 |
|
| María A. Balboa |
| Investigadora Científica, Consejo Superior de Investigaciones Científicas (CSIC) |
| Correo electrónico: mbalboa@ibgm.uva.es |
| Teléfono despacho: +34-983-184-833 |
| Teléfono laboratorio: +34-983-184-832 |
| Página web del laboratorio: The Eicosanoid Research Division |
|
Nuestro grupo está interesado en el estudio de enzimas del metabolismo lipídico conocidas como lipinas que desfosforilan el ácido fosfatídico para producir diacilglicerol. Por su actividad enzimática las lipinas podrían actuar como maquinarias generadoras de señales intracelulares, y también como controladoras del almacenamiento de lípidos en las células. A pesar de que algunas mutaciones en los genes LPIN producen en humanos enfermedades de base inflamatoria, muy poco se conoce del papel de las lipinas en la biología de las células del sistema inmune, y mucho menos en procesos inflamatorios. Nuestro trabajo es precisamente desvelar el papel de las lipinas en estos procesos.
Los lípidos neutros se acumulan en las células en forma de triacilglicerol (TAG), que constituye la principal reserva energética del organismo. La síntesis de TAG tiene lugar en el retículo endoplásmico, donde están localizadas la mayoría de las enzimas de su ruta biosintética. El estudio de las enzimas implicadas en la síntesis de TAG en un contexto inmunológico podría no sólo desvelar nuevas vías de conexión entre inmunidad y sistema metabólico, sino permitir también el desarrollo de nuevas estrategias en el control de los procesos inflamatorios y, especialmente, de aquellos que tienen lugar durante la obesidad. El precursor directo de TAG, el diacilglicerol (DAG) es producido por la desfosforilación del ácido fosfatídico (PA) en esta ruta biosintética. Dicha reacción es catalizada por una familia de enzimas, las fosfatasas de PA, entre las que se encuentra la famila de las lipinas. La primera lipina descrita es una proteína codificada por el gen Lpin 1 que fue identificado por clonación posicional como el gen mutado en la distrofia de hígado graso (fld) en ratón. Dos genes adicionales de mamíferos, Lpin2 y Lpin3 fueron identificados gracias a su similitud de secuencia. Se ha visto que la lipina controla el metabolismo de las grasas en células mamíferas. En el ratón fld, la falta de lipina previene el desarrollo normal del tejido adiposo, y por ello, se produce lipodistrofia (tejido adiposo reducido, hígado graso transitorio, altos niveles de triglicéridos y aterosclerosis), resistencia a la insulina y neuropatía periférica progresiva; mientras que el exceso de lipina produce obesidad.
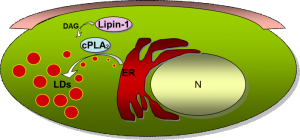
Hasta el momento, pocos estudios se han centrado en el posible papel de la lipina en la regulación de los procesos inmunes. Nuestras investigaciones previas han indicado que en células humanas promonocíticas la inhibición de la actividad lipina produce una profunda desregulación del metabolismo lipidico de estas células, disminuyendo la síntesis de los fosfolípidos y triglicéridos, e incluso llegando a producir apoptosis por la ruta mitocondrial. También, se ha encontrado que la lipina podría estar relacionada con la activación y expresión de importantes enzimas de la ruta biosintética de mediadores lipídicos proinflamatorios. Así por ejemplo, la inducción de la ciclooxigenasa 2 (COX-2), enzima que metaboliza el AA a prostaglandinas, se bloquea por inhibidores que disminuyen la actividad lipina. En ciertos sistemas celulares, el DAG generado por la lipina facilita la interacción de la fosfolipasa A2 citosólica de grupo IVA (cPLA2) con sus sustratos, produciéndose la liberación de ácido araquidónico de los fosfolípidos de membrana. Recientemente, hemos observado que en macrófagos humanos la lipina-1 se localiza en la superficie de los orgánulos de almacenamiento de TAG celulares conocidos como gotas lipídicas (lipid droplets). Otros experimentos de expresión génica por analisis en “arrays” muestran que la lipina 1 regula la expresión de múltiples genes en macrófagos peritoneales de ratón tras activación con lipopolisacárido (LPS) procedente de la pared bacteriana de E. coli. Entre estos genes se encuentran la óxido nítrico sintasa inducible (iNOS), que tiene una importante función en la eliminación de microorganismos invasores, y la IL-23, interleuquina proinflamatoria que mantiene respuestas Th17, importantes en la eliminación de patógenos y en autoinmunidad.
Nuestros objetivos específicos de estudio son:
1) definir qué metabolitos producidos o eliminados por la acción de la lipina controlan la generación de factores proinflamatorios en macrófagos, cómo lo hacen y cuál es el impacto de todo ello en modelos murinos de inflamación,
2) definir el papel de la lipina en la activación macrófagica por ácidos grasos de la dieta, diseccionando las rutas de transducción se señal implicadas,
3) definir el papel de la lipina en la generación y mantenimeinto de las gotas lipídicas, orgánulos celulares donde se almacenan los lípidos y que parecen tener un importante papel en la respuesta inflamatoria de los macrófagos,
4) definir el impacto lipidómico de la ausencia de lipinas en los macrófagos durante los procesos inflamatorios.
References
1. Fuentes, L.,
Pérez, R., Nieto, M. L., Balsinde, J. & Balboa, M. A. (2003) Bromoenol
lactone promotes cell death by a mechanism involving phosphatidate
phosphohydrolase-1 rather than calcium-independent phospholipase A2.
J. Biol. Chem. 278: 44683-44690.
2. Balsinde, J.
& Balboa, M. A. (2005) Cellular regulation and proposed biological
functions of group VIA calcium-independent phospholipase A2 in
activated cells. Cell. Signal. 17:
1052-1062.
3. Casas, J., Gijón,
M. A., Vigo, A. G., Crespo, M. S., Balsinde, J. & Balboa, M. A. (2006)
Phosphatidylinositol 4,5-bisphosphate anchors cytosolic group IVA phospholipase
A2 to perinuclear membranes and decreases its calcium requirement
for translocation in live cells. Mol.
Biol. Cell 17: 155-162.
4. Casas, J., Gijón,
M. A., Vigo, A. G., Crespo, M. S., Balsinde, J. & Balboa, M. A. (2006)
Overexpression of cytosolic group IVA phospholipase A2 protects
cells from calcium-dependent death. J.
Biol. Chem. 281: 6106-6116.
5. Pérez, R.,
Matabosch, X., Llebaria, A., Balboa, M. A. & Balsinde, J. (2006) Blockade
of arachidonic acid incorporation into phospholipids induces apoptosis in U937
promonocytic cells. J. Lipid Res. 47:
484-491.
6. Pérez, R.,
Balboa, M. A. & Balsinde, J. (2006) Involvement of group VIA
calcium-independent phospholipase A2 in macrophage engulfment of
hydrogen peroxide-treated U937 cells. J.
Immunol. 176: 2555-2561.
7. Balsinde, J.,
Pérez, R. & Balboa, M. A. (2006) Calcium-independent phospholipase A2
and apoptosis. Biochim. Biophys. Acta
1761: 1344-1350.
8. Pindado, J.,
Balsinde, J. & Balboa, M. A. (2007) TLR3-dependent induction of nitric
oxide synthase in RAW 264.7 macrophage-like cells via a cytosolic phospholipase
A2/cyclooxygenase-2 pathway. J.
Immunol. 179: 4821-4828.
9. Pérez-Chacón, G.,
Astudillo, A. M., Balgoma, D., Balboa, M. A. & Balsinde, J. (2009) Control
of free arachidonic acid levels by phospholipases A2 and
lysophospholipid acyltransferases. Biochim.
Biophys. Acta 1791: 1103–1113.
10. Ruipérez, V., Astudillo, A. M., Balboa, M. A. &
Balsinde, J. (2009) Coordinate regulation of Toll-like receptor-mediated
arachidonic acid mobilization in macrophages by group IVA and group V
phospholipase A2s. J. Immunol.
182: 3877–3883.
11. Casas, J., Meana, C., Esquinas, E., Valdearcos, M.,
Pindado, J., Balsinde, J. & Balboa, M. A. (2009) Requirement of
JNK-mediated phosphorylation for translocation of group IVA phospholipase A2
to phagosomes in human macrophages. J.
Immunol. 183: 2767–2774.
12. Casas, J., Valdearcos, M., Pindado, J., Balsinde, J.
& Balboa, M. A. (2010) The cationic cluster of group IVA phospholipase A2
(Lys488/Lys541/Lys543/Lys544) is involved in translocation of the enzyme to
phagosomes in human macrophages. J. Lipid
Res. 51: 388–399.
12. Valdearcos, M., Esquinas, E., Meana, C., Gil-de-Gómez,
L., Guijas, C., Balsinde, J. & Balboa, M. A. (2011) Subcellular
localization and role of lipin-1 in human macrophages. J. Immunol. 186: 6004–6013.
14. Guijas, C., Pérez-Chacón, G., Astudillo, A. M., Rubio,
J. M., Gil-de-Gómez, L., Balboa, M. A. & Balsinde, J. (2012) Simultaneous
activation of p38 and JNK by arachidonic acid stimulates the cytosolic
phospholipase A2-dependent synthesis of lipid droplets in human
monocytes. J. Lipid Res. 53:
2343–2354.
15. Astudillo, A. M.,
Balgoma, D., Balboa, M. A. & Balsinde, J. (2012) Dynamics of arachidonic
acid mobilization by inflammatory cells. Biochim
Biophys. Acta 1821: 249–256.
16. Astudillo, A. M.,
Pérez-Chacón, G., Meana, C., Balgoma, D., Pol, A., del Pozo, M. A., Balboa, M.
A. & Balsinde, J. (2011) Altered arachidonate distribution in macrophages
from caveolin-1 null mice leading to reduced eicosanoid synthesis. J. Biol. Chem. 286: 35299–35307.
17. Valdearcos, M., Esquinas, E., Meana, C., Peña, L.,
Gil-de-Gómez, L., Balsinde, J. & Balboa, M. A. (2012) Lipin-2 reduces
proinflammatory signaling induced by saturated fatty acids in macrophages. J. Biol. Chem. 287: 10894-10904.
18. Gil-de-Gómez, L., Astudillo, A. M., Meana, C., Rubio, J.
M., Guijas, C., Balboa, M. A. & Balsinde, J. (2013) A phosphatidylinositol
species acutely generated by activated macrophages regulates innate immune
responses. J. Immunol. 190:
5169–5177.
19. Gil-de-Gómez, L., Astudillo, A. M., Guijas, C.,
Magrioti, V., Kokotos, G., Balboa, M. A. & Balsinde, J. (2014) Cytosolic
group IVA and calcium-independent group VIA phospholipases A2 act on
distinct phospholipid pools in zymosan-stimulated mouse peritoneal macrophages.
J. Immunol.
192: 752–762.
20. Meana, C., Peña, L., Lordén, G., Esquinas, E., Guijas,
C., Valdearcos, M., Balsinde, J. & Balboa, M. A. (2014) Lipin-1 integrates
lipid synthesis with proinflammatory responses during TLR activation in
macrophages.
J. Immunol. 193: 4614-4622.




