Nuestra investigación
La investigación una herramienta para mejorar la calidad de vida de las personas y ayudar al bienestar de la sociedad.
Descubre aquí cómo impulsamos la innovación para mejorar vidas

Nuestra misión
Queremos contribuir a la búsqueda de soluciones científicas para la prevención y cura de las enfermedades metabólicas.
- Generando conocimiento frontero en la comprensión de los procesos de las enfermedades metabólicas.
- Aplicando tecnologías avanzadas
- Identificando nuevas dianas farmacológicas
- Desarrollando nuevos fármacos para la profilaxis y tratamiento de las enfermedades metabólicas.
Enfermedades Metabólicas
La diabetes y la obesidad son las epidemias del siglo XXI afectando a más de 422 y 650 millones de personas, respectivamente, en el mundo. En España, la prevalencia de la diabetes y obesidad es del 13.8%, y del 14.5% respectivamente, y este índice va en aumento debido al sobrepeso, el envejecimiento de la población, y los hábitos de vida poco saludables (vida sedentaria y malos hábitos de alimentación).
Entre las manifestaciones clínicas de la fisiopatología de la diabetes se encuentran la resistencia a la insulina, intolerancia a la glucosa, hiperinsulinemia e hiperglucagonemia. Estas alteraciones metabólicas tienen su origen en el páncreas endocrino (células beta y alfa pancreáticas), el hígado, el músculo esquelético y el tejido adiposo.
Nuestra investigación
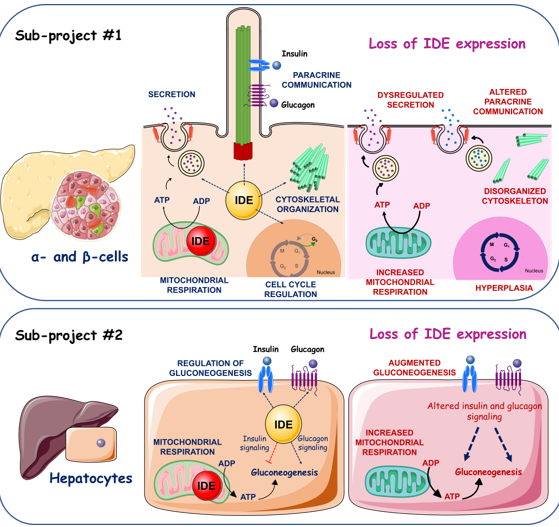
Llevamos una década estudiando una proteasa ubicua que es capaz de degradar a la insulina y el glucagón denominada insulin-degrading enzyme (IDE). Estudios genéticos en humanos y roedores han identificado polimorfismos en el gen de Ide asociados a un aumento en la susceptibilidad a desarrollar diabetes.
Nuestro grupo de investigación ha determinado que la deficiencia de IDE en las células beta y alfa pancreáticas, así como en hepatocitos de hígado causan la aparición de las alteraciones metabólicas observadas en los pacientes diabéticos. Esto ha sido posible gracias al desarrollado varios modelos preclínicos murinos de estudio de la diabetes, en los que se ha eliminado la expresión del gen de Ide en las células beta- y alfa-pancreáticas, y en los hepatocitos.
Proyectos financiados
PAPEL DE INSULIN-DEGRADING ENZYME EN EL EJE TUBULINA-CILIO PRIMARIO PARA LA REGULACION DE LA SECRECIÓN DE INSULINA Y GLUCAGÓN PID2022-136605OB-C21. Ministerio de Ciencia e Innovación. 2023-2025.
IDE-MEDIATED REGULATION OF MITOCHONDRIAL HOMEOSTASIS IN PANCREAS AND LIVER. PID2022-136605OB-C22. Ministerio de Ciencia e Innovación. 2023-2025.
PAPEL DE IDE EN EL ACLARAMIENTO Y LA ACCION DE LA INSULINA EN EL HIGADO. PID2019-110496RB-C22. Ministerio de Ciencia e Innovación. 2020-2022.
REGULACION PARACRINA MEDIADA POR IDE DE LA FUNCION DE LAS CELULAS DEL ISLOTE PANCREATICO. PID2019-110496RB-C21. Ministerio de Ciencia e Innovación. 2020-2022.
NUEVAS ESTRATEGIAS EN EL TRATAMIENTO DE LA OBESIDAD Y DIABETES MELLITUS EMPLEANDO EL FACTOR DE PREIMPLANTACIÓN (PIF) EN MODELOS PRECLÍNICOS MURINOS. Universidad de Burgos-Fundación la Caixa. 2019-2021.
ROLE OF INSULIN-DEGRADING ENZYME (IDE) IN HEPATIC INSULIN RESISTANCE. 2017 EFSD/MSD European Diabetes Research Programme on New Targets for Type 2 Diabetes. 2018-2019.
PAPEL DE INSULIN DEGRADING ENZYME (IDE) EN LA HIPERGLUCAGONEMIA. SAF2016-77871-C2-1-R. Ministerio de Economía y Competitividad. 2017-2019.
PAPEL DE INSULIN DEGRADING ENZYME (IDE) EN LA HIPERGLUCAGONEMIA. SAF2016-77871-C2-2-R. Ministerio de Economía y Competitividad. 2017-2019.
PAPEL DE INSULIN DEGRADING ENZYME (IDE) EN LA DIABETES MELLITUS Y RESISTENCIA INSULINICA. SAF2014-58702-C2-1-R. Ministerio de Economía y Competitividad. 2015-2016.
PAPEL DE INSULIN DEGRADING ENZYME (IDE) EN LA DIABETES MELLITUS Y RESISTENCIA INSULINICA. SAF2014-58702-C2-2-R. Ministerio de Economía y Competitividad. 2015-2016.
EFECTO TERAPÉUTICO DE LOS FURANOCEMBRANÓLIDOS SOBRE LA RESISTENCIA INSULÍNICA Y DIABETES TIPO 2. Junta de Castilla y León. Consejería de Sanidad. 2015-2015.
OBTENCIÓN DE POLÍMEROS PROTEICOS RECOMBINANTES COMO SOPORTE PARA ENCAPSULAMIENTO DE ISLOTES PANCREÁTICOS Y TRASPLANTE CELULAR. Junta de Castilla y León. Consejería de Educación. 2015-2015.
INSULIN RESISTANCE AND TYPE 2 DIABETES. INSULIN RESISTANCE AND TYPE 2 DIABETES: ROLE OF PANCREATIC BETA CELL REGENERATION. (CP08/00094). ISCIII. 2009-2012.
ROLE OF THE ADIPOKINE HEPATOCYTE GROWTH FACTOR (HGF) IN THE PATHOGENESIS OF MUSCLE INSULIN RESISTANCE. Instituto de Salud Carlos III. Contrato “Miguel Servet (CP08/00106). 2009-2012.
IDENTIFICACIÓN DE MOLÉCULAS PARA LA REGENERACIÓN DE LA CÉLULA BETA PANCREÁTICA. TERAPIA POTENCIAL PARA LA DIABETES MELLITUS. (PS09/00671). ISCIII. 2010-2012.
HEPATIC GROWTH FACTOR AND INSULIN RESISTANCE. SPANISH Ministerio de Economía y Competitividad. SAF2009-11282. 2010-2012.
ROLE OF PANCREATIC BETA-CELL REGENERATION IN THE PATHOFISIOLOGY AND TREATMENT OF INSULIN RESISTANCE AND TYPE 2 DIABETES. (IRG-247835). FP7-International-RG-Marie Curie Actions (Europe). 2009-2012.
HEPATIC GROWTH FACTOR AND INSULIN RESISTANCE. (IRG- 256369). FP7-International-RG-Marie Curie Actions (Europe). 2010-2013.
Publicaciones más relevantes
- Pharmacological activation of insulin-degrading enzyme improves insulin secretion and glucose tolerance in diet-induced obese mice.
Sanz-González A, Cózar-Castellano I, Broca C, Sabatier J, Acosta GA, Royo M, Hernándo-Muñoz C, Torroba T, Perdomo G, Merino B. Diabetes Obes Metab. 2023 Jul 26. doi: 10.1111/dom.15225.
- Altered Surface Expression of Insulin-Degrading Enzyme on Monocytes and Lymphocytes from COVID-19 Patients Both at Diagnosis and after Hospital Discharge. González-Casimiro CM, Arribas-Rodríguez E, Fiz-López A, Casas J, Gutiérrez S, Tellería P, Novoa C, Rojo-Rello S, Tamayo E, Orduña A, Dueñas C, Bernardo D, Perdomo G. Int J Mol Sci. 2022 Sep 21;23(19):11070
- Primary Cilia in Pancreatic β- and α-Cells: Time to Revisit the Role of Insulin-Degrading Enzyme. Pablos M, Casanueva-Álvarez E, González-Casimiro CM, Merino B, Perdomo G, Cózar-Castellano I. Front Endocrinol (Lausanne). 2022 Jun 27;13:922825. doi: 10.3389/fendo.2022.922825.
- Insulin-degrading enzyme ablation in mouse pancreatic alpha cells triggers cell proliferation, hyperplasia and glucagon secretion dysregulation. Merino B, Casanueva-Álvarez E, Quesada I, González-Casimiro CM, Fernández-Díaz CM, Postigo-Casado T, Leissring MA, Kaestner KH, Perdomo G, Cózar-Castellano I. Diabetologia. 2022 Aug;65(8):1375-1389. doi: 10.1007/s00125-022-05729-y.
- Effects of Fasting and Feeding on Transcriptional and Posttranscriptional Regulation of Insulin-Degrading Enzyme in Mice. González-Casimiro CM, Cámara-Torres P, Merino B, Diez-Hermano S, Postigo-Casado T, Leissring MA, Cózar-Castellano I, Perdomo G. Cells. 2021 Sep 16;10(9):2446. doi: 10.3390/cells10092446
Targeting Insulin-Degrading Enzyme in Insulin Clearance. Leissring MA, González-Casimiro CM, Merino B, Suire CN, Perdomo G. Int J Mol Sci. 2021 Feb
24;22(5):2235. doi: 10.3390/ijms22052235.
González-Casimiro CM, Merino B, Casanueva-Álvarez E, Postigo-Casado T, Cámara-Torres P, Fernández-Díaz CM, Leissring MA, Cózar-Castellano I, Perdomo G. Biomedicines. 2021 Jan 17;9(1):86
- Hepatic insulin-degrading enzyme regulates glucose and insulin homeostasis in diet-induced obese mice. Merino B, Fernández-Díaz CM, Parrado-Fernández C, González-Casimiro CM, Postigo-Casado T, Lobatón CD, Leissring MA, Cózar-Castellano I, Perdomo G. Metabolism. 2020 Sep 8:154352.
- Modulation of Glial Responses by Furanocembranolides: Leptolide Diminishes Microglial Inflammation in Vitro and Ameliorates Gliosis In Vivo in a Mouse Model of Obesity and Insulin Resistance. Corraliza-Gómez M, Gallardo AB, Díaz-Marrero AR, de la Rosa JM, D'Croz L, Darias J, Arranz E, Cózar-Castellano I, Ganfornina MD, Cueto M. Mar Drugs. 2020 Jul 22;18(8):378.
- Assessment of Insulin Tolerance Ex Vivo. Cózar-Castellano I, Perdomo G. Methods Mol Biol. 2020;2128:291-300.
- Assessment of Insulin Tolerance In Vivo in Mice. Cózar-Castellano I, Perdomo G. Methods Mol Biol. 2020;2128:217-224.
- Intestinal Fructose and Glucose Metabolism in Health and Disease. Merino B, Fernández-Díaz CM, Cózar-Castellano I, Perdomo G. Nutrients. 2019 Dec 29;12(1):94.
- Pancreatic β-cell-specific deletion of insulin-degrading enzyme leads to dysregulated insulin secretion and β-cell functional immaturity. Fernández-Díaz CM, Merino B, López-Acosta JF, Cidad P, de la Fuente MA, Lobatón CD, Moreno A, Leissring MA, Perdomo G, Cózar-Castellano I. Am J Physiol Endocrinol Metab. 2019 Nov 1;317(5):E805-E819.
- Manipulation of Transmembrane Transport by Synthetic K+ Ionophore Depsipeptides and Its Implications in Glucose-Stimulated Insulin Secretion in β-Cells. García-Calvo J, Torroba T, Brañas-Fresnillo V, Perdomo G, Cózar-Castellano I, Li YH, Legrand YM, Barboiu M. Chemistry. 2019 Jul 11;25(39):9287-9294.
- Hepatic Insulin Clearance: Mechanism and Physiology. Najjar SM, Perdomo G. Physiology (Bethesda). 2019 May 1;34(3):198-215.
- Liver-specific ablation of insulin-degrading enzyme causes hepatic insulin resistance and glucose intolerance, without affecting insulin clearance in mice. Villa-Pérez P, Merino B, Fernández-Díaz CM, Cidad P, Lobatón CD, Moreno A, Muturi HT, Ghadieh HE, Najjar SM, Leissring MA, Cózar-Castellano I, Perdomo G. Metabolism. 2018 Nov;88:1-11.
- Insulin degrading enzyme is up-regulated in pancreatic β cells by insulin treatment. Fernández-Díaz CM, Escobar-Curbelo L, López-Acosta JF, Lobatón CD, Moreno A, Sanz-Ortega J, Perdomo G, Cózar-Castellano I. Histol Histopathol. 2018 Nov;33(11):1167-1180.
- LRH-1 agonism favours an immune-islet dialogue which protects against diabetes mellitus. Cobo-Vuilleumier N, Lorenzo PI, Rodríguez NG, Herrera Gómez IG, Fuente-Martin E, López-Noriega L, Mellado-Gil JM, Romero-Zerbo SY, Baquié M, Lachaud CC, Stifter K, Perdomo G, Bugliani M, De Tata V, Bosco D, Parnaud G, Pozo D, Hmadcha A, Florido JP, Toscano MG, de Haan P, Schoonjans K, Sánchez Palazón L, Marchetti P, Schirmbeck R, Martín-Montalvo A, Meda P, Soria B, Bermúdez-Silva FJ, St-Onge L, Gauthier BR. Nat Commun. 2018 Apr 16;9(1):1488.
- Chloro-Furanocembranolides from Leptogorgia sp. Improve Pancreatic Beta-Cell Proliferation. Gallardo AB, Díaz-Marrero AR, de la Rosa JM, D'Croz L, Perdomo G, Cózar-Castellano I, Darias J, Cueto M.Mar Drugs. 2018 Feb 2;16(2):49.
- Leptolide Improves Insulin Resistance in Diet-Induced Obese Mice. Villa-Pérez P, Cueto M, Díaz-Marrero AR, Lobatón CD, Moreno A, Perdomo G, Cózar-Castellano I. Mar Drugs. 2017 Sep 15;15(9):289.
- Cyclin C stimulates β-cell proliferation in rat and human pancreatic β-cells. Jiménez-Palomares M, López-Acosta JF, Villa-Pérez P, Moreno-Amador JL, Muñoz-Barrera J, Fernández-Luis S, Heras-Pozas B, Perdomo G, Bernal-Mizrachi E, Cózar-Castellano I. Am J Physiol Endocrinol Metab. 2015 Mar 15;308(6):E450-9.
- Central proliferation and neurogenesis is impaired in type 2 diabetes and prediabetes animal models. Ramos-Rodriguez JJ, Molina-Gil S, Ortiz-Barajas O, Jimenez-Palomares M, Perdomo G, Cozar-Castellano I, Lechuga-Sancho AM, Garcia-Alloza M. PLoS One. 2014 Feb 20;9(2):e89229.
- Differential central pathology and cognitive impairment in pre-diabetic and diabetic mice.Ramos-Rodriguez JJ, Ortiz O, Jimenez-Palomares M, Kay KR, Berrocoso E, Murillo-Carretero MI, Perdomo G, Spires-Jones T, Cozar-Castellano I, Lechuga-Sancho AM, Garcia-Alloza M. Psychoneuroendoc. 2013 Nov; 38(11):2462-75.
- Epoxypukalide induces proliferation and protects against cytokine-mediated apoptosis in primary cultures of pancreatic β-cells. López-Acosta JF, Moreno-Amador JL, Jiménez-Palomares M, Díaz-Marrero AR, Cueto M, Perdomo G, Cózar-Castellano I. PLoS One. 2013;8(1):e52862.
- Increased Aβ production prompts the onset of glucose intolerance and insulin resistance. Jiménez-Palomares M, Ramos-Rodríguez JJ, López-Acosta JF, Pacheco-Herrero M, Lechuga-Sancho AM, Perdomo G, García-Alloza M, Cózar-Castellano I. Am J Physiol Endocrinol Metab. 2012 Jun 1;302(11):E1373-80.
- FoxO6 integrates insulin signaling with gluconeogenesis in the liver. Kim DH, Perdomo G, Zhang T, Slusher S, Lee S, Phillips BE, Fan Y, Giannoukakis N, Gramignoli R, Strom S, Ringquist S, Dong HH.Diabetes. 2011 Nov;60(11):2763-74.
- FoxO1 links insulin resistance to proinflammatory cytokine IL-1beta production in macrophages. Su D, Coudriet GM, Hyun Kim D, Lu Y, Perdomo G, Qu S, Slusher S, Tse HM, Piganelli J, Giannoukakis N, Zhang J, Dong HH. Diabetes. 2009 Nov;58(11):2624-33.
- A role of apolipoprotein D in triglyceride metabolism. Perdomo G, Kim DH, Zhang T, Qu S, Thomas EA, Toledo FG, Slusher S, Fan Y, Kelley DE, Dong HH.J Lipid Res. 2010 Jun;51(6):1298-311.
- Induction of human beta-cell proliferation and engraftment using a single G1/S regulatory molecule, cdk6. Fiaschi-Taesch NM, Salim F, Kleinberger J, Troxell R, Cozar-Castellano I, Selk K, Cherok E, Takane KK, Scott DK, Stewart AF. Diabetes. 2010 Aug;59(8):1926-36.
- Survey of the human pancreatic beta-cell G1/S proteome reveals a potential therapeutic role for cdk-6 and cyclin D1 in enhancing human beta-cell replication and function in vivo. Fiaschi-Taesch N, Bigatel TA, Sicari B, Takane KK, Salim F, Velazquez-Garcia S, Harb G, Selk K, Cozar-Castellano I, Stewart AF .Diabetes. 2009 Apr;58(4):882-93.
- Molecular control of cell cycle progression in the pancreatic beta-cell. Cozar-Castellano I, Fiaschi-Taesch N, Bigatel TA, Takane KK, Garcia-Ocaña A, Vasavada R, Stewart AF. Endocr Rev. 2006 Jun;27(4):356-70.
Colaboraciones internacionales
Consideramos fundamentales las colaboraciones con otros grupos de investigación, para enriquecer nuestra ciencia y la formación de nuestros jóvenes investigadores. Por ello colaboramos con varios investigadores, algunos de ellos antiguos compañeros de laboratorio. Nuestros estudiantes realizan estancias internacionales en laboratorios de grupos con los que mantenemos colaboración, y algunos de nuestros colaboradores también hacen labores de tutorización con nuestros estudiantes de doctorado. Ente nuestros colaboradores internacionales se encuentran:
- Andrew F. Stewart (Mount Sinai School of Medicine, NY, EEUU)
- Adolfo García-Ocaña (Mount Sinai School of Medicine, NY, EEUU)
- Rupangi Vasavada (Department of Translational Research and Cellular Therapeutics, City of Hope, CA, EEUU)
- Klaus Kaestner (University of Pennsylvania, EEUU)
- Ernesto Bernal-Mizrachi (University of Miami, Florida, EEUU)
- Henry Dong (University of Pittsburgh, EEUU)
- Malcolm Leissring (University of California, Irvine, EEUU)
- Sonia Najjar (University of Ohio, EEUU)
- Safia Costes (IGF-CNRS, Montpellier, Francia)
Información de contacto
Nuestro grupo de investigación se encuentra ubicado en el laboratorio B2 del IBGM.

Twitter @DiabetesLabIBGM
Telefono +34-983184005
